指导原则
抗肿瘤治疗的免疫相关不良事件评价技术指导原则
抗肿瘤治疗的免疫相关不良事件评价技术指导原则
一、背景
肿瘤免疫治疗(immuno-oncology,IO)是当前抗肿瘤新药的重要研发领域,随着多个靶向程序性死亡受体 1
(programmed death-1, PD-1)或其配体等免疫检查点抑制剂
(immune checkpoint inhibitors, ICIs)[1-3]、双特异性 T 细胞连接抗体(Bispecific T cell Engager, BiTE)、激动剂抗体以及细胞治疗产品等在全球批准上市[4, 5],免疫治疗已逐渐成为多种恶性肿瘤的标准治疗手段,目前尚有大量新的免疫靶点药物正处在临床研发的不同阶段[6]。制药企业和学术界在不断探索新靶点、更精准的治疗人群和更有效联合治疗方案的同时,也越来越清楚地认识到免疫治疗药物与传统的细胞毒药物和小分子靶向药物在安全性上具有显著的差异,也发现少数非免疫治疗与免疫治疗具有相似的安全性特征。
免疫相关不良事件(immune-related adverse event, irAE) 的识别和判定领域目前尚无相关技术指导原则,使得在不同的药物临床试验中,存在不同的 irAE 定义和判定流程,在对安全性数据进行汇总时,难以全面系统地识别和分析 irAE, 这将不利于说明书安全性信息的充分呈现,并可能影响患者的用药安全。为此,我们根据免疫治疗药物的作用机制和irAE 特点,对 irAE 的定义和判定流程提出科学性建议,明
目录
二、定义及判定考虑.................................... 2
(一)免疫相关不良事件的定义.......................... 2
(二) 判定医学考虑................................... 4
(三)判定流程....................................... 6
三、说明书免疫相关不良事件的呈现....................... 7
(一)一般原则....................................... 7
(二)特殊情形的考虑................................. 9
(三)安全信息的更新................................ 10
确在不同研究设计的临床试验中 irAE 的数据呈现形式,并阐明说明书中相关不良反应信息撰写考虑。
本指导原则适用于肿瘤免疫治疗。本指导原则旨在提升肿瘤免疫治疗临床试验 irAE 识别和判定的科学性和稳健性, 提高研究者手册、临床研究报告(clinical study report, CSR)、 临床安全性总结(summary of clinical safety, SCS)和说明书药物不良反应(adverse drug reaction, ADR)的撰写质量,加强对参加试验的受试者和上市后用药患者人群的保护。
本指导原则仅代表药品监管部门当前的观点和认知,随着医学科学和临床试验的发展,本指导原则中的相关内容将不断完善与更新。应用本指导原则设计和实施研究时,请同时参考药物临床试验质量管理规范(good clinical practice,
GCP)、国际人用药品注册技术协调会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)和其他国内已发布的相关指导原则。
二、 定义及判定考虑
(一)免疫相关不良事件的定义
当前,建议 irAE 定义为:抗肿瘤药物/治疗临床试验中, 经判定与免疫机制有因果关系的所有级别的药物不良反应。
虽然称为免疫相关“不良事件”,但 irAE 实际是因抗肿瘤药物作用机制导致的免疫机制介导引起的“不良反应”。irAE 应基于药物警戒标准和
MedDRA 术语编码进行识别和表征, 是 AE、治疗中出现的不良事件(treatment emergent adverse event, TEAE)和 ADR 的子集(图 1)。
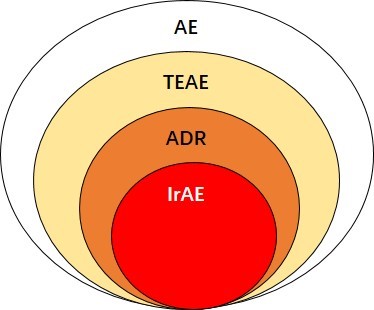
图 1、免疫相关不良事件的定义及关系
当前肿瘤免疫治疗临床试验方案中免疫相关事件存在多种定义——免疫相关不良事件(immune-related adverse event, irAE)、免疫介导不良事件(immune-mediated adverse event, imAE)和免疫相关不良反应(immune-related adverse drug reaction, irADR)等,上述术语定义存在交集和差异。为提高 irAE 判定的科学性、一致性和可操作性,结合当前临床实践,并便于国际之间、学术界与行业间的交流,建议采用免疫相关不良事件(irAE)统一描述肿瘤免疫治疗临床试验中的免疫相关安全性事件。如需在临床试验中应用其它免疫
相关术语,如 imAE 或 irADR 等,建议申办者明确不同术语的定义及使用场景,明确其与 irAE 的异同。
(二) 判定医学考虑
IrAE 是由免疫机制介导发生的,临床表现主要与免疫细胞的活化相关,具有如下特征:
● 通常为脱靶免疫反应,可累及单个或多个器官系统;
● 部分产品的剂量-暴露量-安全性特征不明确,低剂量也可能导致严重 irAE;
● 发生时间多样,部分在用药后较快发生(如细胞因子释放综合征通常在 48 小时内发生),并迅速加重;部分具有迟滞效应,在用药数月后发生;部分在停药后发生并持续加重;
● 部分 irAE 的发生率极低,需大样本和长时间观察才能暴露;
● 不同作用机制的产品可具有相似的 irAE[7]。
如前所述,irAE 为 ADR。常规 ADR 的判定通常考虑如下因素:事件与治疗的时间相关性,生物学合理性,去激发或再激发试验结果(如有),试验组与对照组之间 AE 发生率的比较,药理学和/或毒理学研究数据支持,剂量-暴露量-事件相关性(如有),以及同靶点药物不良反应等。对于存在时间相关性且不存在其他重要混杂因素的罕见严重事件,也常
被判定为 ADR,如史蒂文斯-约翰逊综合征(Stevens-Johnson syndrome, SJS)和中毒性表皮坏死解松解症(toxic epidermal necrosis, TEN)。
基于前述 irAE 的特点,在临床试验中,往往难以完全参照 ADR 判定的一般性原则判定 irAE。因此,建议进一步考虑如下因素判定 irAE:
(1) 针对目标 irAE(包括疑似 irAE)是否使用了全身类固醇治疗、其他免疫抑制治疗或内分泌替代治疗,以及治疗后转归;
(2) 病理检测结果(如有);
(3) 靶点免疫学机制;
(4) 事件与治疗的时间相关性,包括长期用药后发生,重新用药后事件是否再次出现或加重,以及停药后发生并加重的情形;
(5) 该事件同靶点药物已报告并明确为 irAE;
(6) 目标 irAE 严重程度,单器官还是多器官/系统累及;
(7) 患者自身免疫疾病病史和基线疾病状态;
(8) 安全性相关生物标记物的支持(如有);
(9) 排除其他病因,与临床表现相似的非免疫事件的重要临床鉴别诊断(如免疫相关性肺炎和感染性肺炎);
(10) 排除其他可导致目标不良事件的合理解释(例如感染、合并用药和基础疾病等)。
(三)判定流程
在产品总体医学判定上,申办者可结合研究方案的定义、数据收集等各方面考量,制定科学的流程进行判定。当前针 对 irAE 总体判定流程,包括但不限于以下方式:
(1) 基于试验总体 AE 通过预设流程进行综合评价。该判定流程是先对所有 AE 进行汇总,在汇总 AE 的基础上, 通过预设流程,从 AE 中筛选并判定 irAE。
(2) 在研究者判定结果基础上,申办者按照预先设定的流程进一步评价汇总。研究者通常基于医疗经验进行 irAE 判定;申办者在研究者判定的基础上,基于在既往临床试验中获得的经验,再次进行 irAE 判定。
(3) 采用预设医学逻辑进行计算机程序判定。需要考虑程序预设医学逻辑的科学性、严谨性和全面性,并经过充分验证。
无论采用上述哪一种流程,或探索新的判定流程,均建议申办者参考本指导原则提供的 irAE 定义和医学判定考虑, 设计科学合理的流程综合判定。申办者的判定人员应具备相应医学资质和判定经验,推荐采用多学科参与的判定模式提
高判定结果的科学性和稳健性。对于通用不良事件评价
(common terminology criteria for adverse events, CTCAE)严重等级 4-5 级 irAE 以及后续造成了严重危害的非预期 3 级irAE,建议申办者采用多学科机制逐例判定相关性,发挥研究者的作用。
三、说明书免疫相关不良事件的呈现
(一)一般原则
研究者是临床试验中 AE 药物相关性的首个判定主体, 直接与受试者接触掌握其全面临床信息,因此,研究者的评价结果有重要的价值。建议在 SCS 等研究资料中,合理呈现研究者和申办者的判定结果,提供申办者的详细评价流程, CTCAE 严重等级 4-5 级判定不一致的病例宜有合理的分析解释。
说明书通常呈现经申办者判断、技术审评部门核定后确认与药物相关的不良反应。建议采用本指导原则所推荐的irAE 定义,并参照已发布的《抗肿瘤药物说明书不良反应数据汇总指导原则》[8]和《抗肿瘤创新药上市申请安全性总结资料准备技术指导原则》[9],以汇总形式在说明书【不良反应】项下呈现 irAE。原则上,说明书【不良反应】信息的撰
写基于申办者汇总判定后的数据。
说明书中应呈现重要器官/系统(如免疫相关性心肌炎、免疫相关性肺炎和免疫相关性内分泌疾病)的 irAE 信息,包括临床试验中发生率较高的 irAE,以及发生率低但可导致严重后果的 irAE。可合并情况下,建议以术语簇形式呈现 irAE
(例如免疫相关性内分泌疾病),减少呈现单个 PT 术语所导致的发生率分散和临床关注度的下降,汇总同时建议准确呈现单个免疫相关事件的发生率,如垂体炎、甲状腺功能减退症、肾上腺功能不全和糖尿病等。在系统性呈现 irAE 时,建议涵盖如下因素:目标 irAE 在临床试验中的汇总累积发生率、严重级别 3 级及以上事件发生率、导致死亡结局的 irAE 发生率、典型临床表现、至事件发生时间、持续时间、是否导致治疗暂停或终止、剂量-暴露量-效应特点(如有)、高危人群特征(如有)、预后和临床转归等。建议明确目标 irAE 需要使用系统性皮质醇激素、其他免疫抑制剂治疗或内分泌替代治疗的比例以及转归,为医患提供更有价值信息。对于不同适应症,如果特定 irAE 在某个特定肿瘤类型下具有显著的性质、频率或严重程度差异,呈现时应加以强调。
同靶点产品可能具备的相似的 irAE 特征,靶点机制相关的严重、罕见和需要特别关注的 irAE 可能因产品当前暴露量和访视时间有限而尚未报告,因此,建议在说明书中提
示本品尚未报告但同类上市产品已报告的 irAE,以充分提醒医患用药风险。
(二)特殊情形的考虑
(1) 对照设计的临床试验,在 CSR 和 SCS 中可考虑呈现试验组和对照组的 irAE,但当对照组为安慰剂或非免疫治疗药物/疗法时,不建议在说明书中呈现安慰剂/阳性对照药的 irAE。
(2) 对照临床试验中采用交叉设计时,由于试验组和对照组交叉人群所接受的免疫治疗方案和暴露时间可能不同, 建议在 CSR 和 SCS 中单独呈现交叉人群的 irAE。在说明书
【不良反应】撰写中,可参照《抗肿瘤药物说明书不良反应数据汇总指导原则》[8],将相对同质人群的 irAE 数据汇总呈现。
(3) 免疫联合治疗设计的试验,判定 irAE 与其中特定药物的相关性存在一定挑战,当前有如下建议:
①如免疫联合治疗与单药治疗具有相似的 irAE 特征, 建议明确 irAE 与联合治疗的相关性,不过度强调与某一目标药物的相关性。与单药相比,免疫联合治疗在 irAE 性质、频率或严重程度方面观察到提高时,呈现时应加以强调。
②如免疫联合治疗与单药治疗具有显著不同的 irAE 特征,建议尽可能明确 irAE 与方案中的单药的相关性。
(4) 免疫联合非免疫治疗中,如果免疫与非免疫治疗具有相似的 AE 特征(例如,免疫治疗和靶向治疗均已知与甲状腺疾病有关),经充分医学评价仍无法确定所观察到的AE是 irAE 还是非 irAE 时,须用保守方法,将 AE 视为irAE,不应仅依据两者特征相似,而排除 irAE。
(三)安全信息的更新
足够的暴露量和相对充分的暴露时间对发现相对罕见、严重的 irAE 具有重要意义,应关注肿瘤免疫治疗药物/疗法的全生命周期药物安全性数据的收集,特别是上市后收集到的罕见、严重和致死性不良事件,应全面收集数据,评估事件与治疗的相关性。参照 ICH 相关指南建议制定合理的核心数据表(core data sheet, CDS)更新计划[10],并依据更新数据及时修订说明书。当明确了新的免疫相关的已识别重要风险时,应及时补充至说明书中。
四、总结
本技术指导原则旨在阐述药品监管机构当前对抗肿瘤治疗临床试验 irAE 的评价和说明书撰写考虑,目标是提高
安全性报告和说明书等资料质量,加强对参与临床试验的受试者和上市后用药的患者人群的保护。本技术指导原则尚不能涵盖抗肿瘤治疗中 irAE 识别、判定和说明书撰写的所有情形,鼓励研发从业者与药品监管机构及时沟通,持续完善本指导原则。
参考文献
[1] Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med. 2018. 379(21): 2040-2051.
[2] Schmid P, Adams S, Rugo HS, et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018. 379(22): 2108-2121.
[3] Baas P, Scherpereel A, Nowak AK, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet. 2021. 397(10272): 375-386.
[4] Foa R, Bassan R, Vitale A, et al. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. N Engl J Med. 2020. 383(17): 1613-1623.
[5] Wang M, Munoz J, Goy A, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. N Engl J Med. 2020. 382(14): 1331-1342.
[6] Kraehenbuehl L, Weng CH, Eghbali S, Wolchok JD, Merghoub T. Enhancing immunotherapy in cancer by targeting emerging immunomodulatory pathways. Nat Rev Clin Oncol. 2021 .
[7] Zhou X, Yao Z, Bai H, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitor-based combination therapies in clinical trials: a systematic review and meta- analysis. Lancet Oncol. 2021. 22(9): 1265-1274.
[8] 国家药监局药审中心关于公开征求《抗肿瘤药物说明书不良反应数据汇总指导
原 则 》 意 见 的 通 知 , https://www.cde.org.cn/main/news/viewInfoCommon/9d3092a2592e5097bb60b34d54 224336.
[9] 国家药监局药审中心关于发布《抗肿瘤创新药上市申请安全性总结资料准备技术指导原则》的通告(2020 年第 56 号)
https://www.cde.org.cn/main/news/viewInfoCommon/6539f28b92b2d7b57579b76006 2ed75a
[10] E2F:研发期间安全性更新报告
https://www.cde.org.cn/ichWeb/guideIch/downloadAtt/2/6defa80786ae8fac5524f9152 a495c84
录入:2022/5/19 8:59:46 点击:2171

